
「極めて遺憾」。厚生労働大臣による2度の遺憾表明で、小林製薬製造の「紅麹」による健康被害問題の状況は一変した。製造管理など小林製薬個社のコンタミネーション(異物混入)と思われる問題は機能性表示食品全体に波及している。業界をあげて制度の信頼回復に向けた環境整備に乗り出す必要がある。
小林の「紅麹」死亡疑い76人
武見敬三厚生労働大臣は、6月28日の会見で、小林製薬の「紅麹」の関与が疑われる死亡例が76例に上ることを公表した。
当初、小林製薬から報告を受けた死亡は5例(3月末時点)。厚労省によると、6月にコールセンター縮小の相談を受け、死亡例の更新がないため6月13日に問い合わせたところ、小林製薬は「報告すべきものはない」と回答。翌14日に調査中の事例があるとの一報を受け、27日に全容を把握したという。
死亡に関する遺族からの相談は、170例。このうち、厚労省は製品利用のある79例について、「製品の使用期間」「使用量」「医療機関受診の有無」「主な症状」等の分類を指示。3例は、医師への意見聴取を通じて製品と因果関係がなく、調査終了と報告を受けた。
武見厚労相は、報告の遅延を受けて「27日に初めて全体像が示された。もう小林製薬だけに任せておくわけにはいかない。厚労省が直接、調査計画を作らせ、進捗管理も行い、詳細に分かるようにする」と冒頭の発言につながった。
都道府県の自治事務である食品監視に国自ら乗り出すのは、雪印乳業の食中毒事件(2000年)など、特異な例。報告遅延に「それも含めしっかり調査する。最終的に今後の対処方針を考える」(武見大臣)とした。
小林製薬、「腎疾患」に絞り死亡集計

回収の公表まで約2カ月を要し、死亡例の正確な報告までさらに2カ月を要したずさんな対応は、企業体質によるものだろう。
76例には、がんや脳梗塞、肺炎による死亡、昨年8~10月頃に製造された特定の原料ロットより前に死亡した事例も含まれていた。小林製薬は、青カビ由来の「プベルル酸」の腎毒性が動物試験で確認されたことから、「腎疾患の発症の有無」に焦点を当て、それ以外の症状を対象外として集計。ほかに生成された化合物の毒性が厚労省主導で検証中であることから、「原因究明の途上のため、個別の事情確認に時間を要し、遺族からの報告のため、関連性の調査・認定が想定以上に困難だった」とする。製品回収の通知も全顧客に送付。購入者以外の遺族から問い合わせが増えたことも実態把握を困難にした。
「最新の事情を踏まえ報告基準を変えるべき」と28日に「死亡との関連性を調査している対象事例数」に対応方針を変更したが、遅きに失したといえるだろう。
小林製薬の企業体質の問題
厚労省と小林製薬で報告基準のすり合わせができていなかった問題も指摘される。
厚労省は、「疑いも含めて健康被害のあるものの報告を求めていた」(健康・生活衛生局食品監視安全課)とするが、報告基準のすり合わせは「ない」(同)。企業関係者からは、「厚労省の不徹底をすり替えている印象もある」、「小林製薬のカウンターパートが機能していない」との意見がある。
ただ、「隠蔽ともとれる報告遅延。制度は性善説に立ち、意図的な隠ぺいは検知できない。OTC、健康食品事業の撤退など人の国に入るものに関わらせるべきではない」、「因果関係の調査は報告後でよかった」、「ずるずると新しい事実が出てくる状況は問題。すべて吐き出してほしい」と、企業体質を指摘する声が強い。過去には、OTCの治験データの改ざん、熱さまし用ジェル状冷却シートによる乳児の窒息事故で、国民生活センターの注意喚起を受けたこともある。
刑事告発の可能性も一部で報道される。ただ、雪印事件は、死亡を含め被害者が1万人以上に上り、大阪府警が業務上過失致死傷の疑いで当時の社長らを書類送検したが、危険性を予見できなかったとして不起訴になっている。厚労省は行政処分について、5月末の定例会見で「食衛法で定める一般衛生管理基準ではカビの発生防止に係る具体的な規定はなく、同法で直ちに問題があったとは言えない。小林製薬への直接の行政処分は、まだ考えていない」と発言している。
一方で食衛法28条は報告遅延の間接罰(罰金50万円)があり、「対象になる可能性はある」(厚労省OB)との見方もある。
「影響ない」もルール強化「仕方ない」
会見の影響は、複数社が「ほとんどなかった」とする。3月の会見後、約40件の問い合わせ・定期解約を受けた売上高数十億円規模の企業は、「5、6月以降の月間の問い合わせは1~2件と収束。28日の厚労省の公表後も問い合わせは1件のみ(7月1日時点)」(月間の問い合わせ数は、2万件前後、健食通販)とする。一方で「新規獲得に向けた広告の休止の影響は、年内は続きそう。減収は避けられない」(別の健食通販)との声もある。
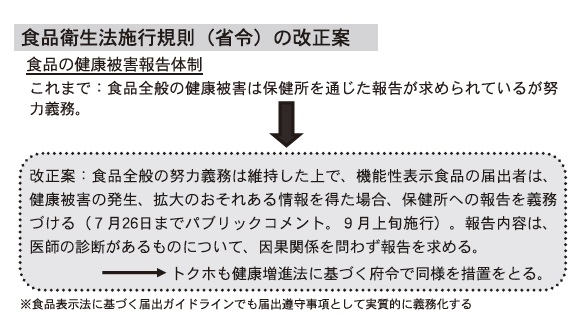
「紅麹」の健康被害問題を受け、政府は、健康被害報告のルール化、サプリメントのGMPを届出事項とすることで実質的に義務化する。食衛法にひもづく施行規則、機能性の届出事項を示す食品表示基準に基づく届出ガイドラインの改正は9月施行に向けパブリックコメントを行っている。
被害報告は、「医師の診断」のあるものについて、「因果関係不明」でも報告を義務化するが、医師の診断は、診断書まで求めず、診察を受けたものも対象になる。厚労省は今年3月、「紅麹」をめぐり、無症状の患者に対する診察も診療報酬(初診料等)の算定を認めており、報告件数は増える可能性がある。
複数社が「個社の製造の問題、かつ原因不明なままで機能性表示食品制度の問題にされている」などとするが、制度厳格化に「一定のハードルは仕方ない」、「安全、安心感の醸成で信頼回復を図る必要がある」と受け入れる。小林製薬には、「対厚労省ではなく、自主的な会見の機会を増やし、信頼回復に努めてほしい」との意見がある。
被害救済など受け皿検討も
サプリメントが法的に位置づけられていない問題もある。米国では、法令違反の対象事業者の公表を行い、医薬品を規制する薬機法も責任役員制度で法令遵守、役員の責任逃れを防ぐ。「法改正を伴わない府省令レベルの対応では、明確な罰則もかけられない」(厚労省OB)など、抜本的な改革を求める声もある。
業界主導の環境整備も必要だ。医薬品は副作用被害救済制度があり、事業者団体による損害保険加入制度の導入は検討に値する。「厳罰化は意味がなく、大多数の真面目な事業者の迷惑。報告隠しの抑制は、医薬品のICHガイドラインのように、品質や安全性、機能性について検討する専門家会議が必要。まず15日など期限を区切り報告させ、因果関係判定や内容精査を称する報告遅延させない環境づくりが必要」との意見もある。信頼回復に向け、”受け皿”整備など、業界の取り組みが必要になる。
会見「予定していない」、健食通販の継続方針「変更ない」
<小林製薬の対応>
小林製薬は、厚労省に二度の報告遅延を指摘された。ただ、会見の予定は「リリースで公表した通り。現時点で予定していない」とする。同社に報告遅延の理由、今後の事業方針を聞いた。
――厚生労働大臣の遺憾表明の受け止めは。
「速やかに報告すべきとの指摘を大変重く受け止めている。関係者に多大な迷惑をおかけしたことに改めて深くお詫び申し上げる。今後、被害発生状況の把握・報告とともに、製品回収、お客様からの問い合わせや補償への誠実な対応、原因究明に全力で取り組む」
――6例目の死亡例の確認はいつか。
「健康被害の報告・公表のあり方の見直しを継続的に検討する中、6月13日に厚生労働省から問い合わせを受け、見直しを加速させ、同27日の報告、28日の公表に至った」
――小林章浩社長への報告頻度は。
「適宜報告していた」
――問題があると公表された原料ロット以外で製造された製品の有無は。
「調査中のため回答できない」
――厚労省と見解の相違の理由は。
「リリースに沿った内容(注・腎疾患の発症から、製品摂取による疑いのある事例数)に変更を予定している」
――因果関係が確認できたものを報告する方針だったのか。報告しなかった理由は。
「76例の死亡の関連性を調査しており、確認が完了していなかった。当初は速報性を重視し、申告内容のみに基づき報告していたが、関連性が遠いと思われる事例もあり、詳細な確認を重視した」
――報告が約2カ月遅れた理由は。
「公表まで時間を要してしまい申し訳ない。当社として、影響を把握するための調査に時間を要した。(問題とされる成分との)因果関係も不明だったが、被害拡大防止を最優先に考え公表した」
――加盟する日本通信販売協会、日本健康・栄養食品協会等の業界団体への報告は。
「個別案件のため回答は控える」
――製造工場の問題に焦点を当てた原因究明、検証は行っているか。製造管理、品質など貴社の問題と捉えているか。
「原因究明は厚労省主導で、当社も引き続き迅速な究明に貢献すべく必要な情報提供を行っている」
――機能性表示食品の問題と捉えているか。
「機能性表示食品のあり方は、政府が対応策をまとめているため、弊社としてその内容を遵守していく」
――通販の定期解約は。
「回答を控える」
――健康食品通販は、3月29日の会見時点で継続を念頭に置いていた。変更はあるか。
「変更はない」
――機能性表示食品の販売は継続するか。
「今後の事業計画に関わるため控える」
――機能性表示食品をはじめ、他社や健康食品業界、通販業界に与える影響への見解は。
「機能性表示食品市場全体の売り上げが下がったとの報道もあり、業界関係者に迷惑をかけ申し訳ないと考えている。影響がどの程度続くかは予測しかねるが、原因究明、再発防止の取り組みを進め信頼回復に努めたい」
――台湾における集団訴訟の対応方針は。
「訴状が届いていないため、現時点でコメントができかねる。台湾の法制度、弊社紅麹原料と健康被害の法的な因果関係等も踏まえ、適切に対応する」。
――国内外の法的措置の把握は。
「回答は控える」











小林の「紅麹」死亡疑い76人
武見敬三厚生労働大臣は、6月28日の会見で、小林製薬の「紅麹」の関与が疑われる死亡例が76例に上ることを公表した。
当初、小林製薬から報告を受けた死亡は5例(3月末時点)。厚労省によると、6月にコールセンター縮小の相談を受け、死亡例の更新がないため6月13日に問い合わせたところ、小林製薬は「報告すべきものはない」と回答。翌14日に調査中の事例があるとの一報を受け、27日に全容を把握したという。
死亡に関する遺族からの相談は、170例。このうち、厚労省は製品利用のある79例について、「製品の使用期間」「使用量」「医療機関受診の有無」「主な症状」等の分類を指示。3例は、医師への意見聴取を通じて製品と因果関係がなく、調査終了と報告を受けた。
武見厚労相は、報告の遅延を受けて「27日に初めて全体像が示された。もう小林製薬だけに任せておくわけにはいかない。厚労省が直接、調査計画を作らせ、進捗管理も行い、詳細に分かるようにする」と冒頭の発言につながった。
都道府県の自治事務である食品監視に国自ら乗り出すのは、雪印乳業の食中毒事件(2000年)など、特異な例。報告遅延に「それも含めしっかり調査する。最終的に今後の対処方針を考える」(武見大臣)とした。
小林製薬、「腎疾患」に絞り死亡集計
76例には、がんや脳梗塞、肺炎による死亡、昨年8~10月頃に製造された特定の原料ロットより前に死亡した事例も含まれていた。小林製薬は、青カビ由来の「プベルル酸」の腎毒性が動物試験で確認されたことから、「腎疾患の発症の有無」に焦点を当て、それ以外の症状を対象外として集計。ほかに生成された化合物の毒性が厚労省主導で検証中であることから、「原因究明の途上のため、個別の事情確認に時間を要し、遺族からの報告のため、関連性の調査・認定が想定以上に困難だった」とする。製品回収の通知も全顧客に送付。購入者以外の遺族から問い合わせが増えたことも実態把握を困難にした。
「最新の事情を踏まえ報告基準を変えるべき」と28日に「死亡との関連性を調査している対象事例数」に対応方針を変更したが、遅きに失したといえるだろう。
小林製薬の企業体質の問題
厚労省と小林製薬で報告基準のすり合わせができていなかった問題も指摘される。
厚労省は、「疑いも含めて健康被害のあるものの報告を求めていた」(健康・生活衛生局食品監視安全課)とするが、報告基準のすり合わせは「ない」(同)。企業関係者からは、「厚労省の不徹底をすり替えている印象もある」、「小林製薬のカウンターパートが機能していない」との意見がある。
ただ、「隠蔽ともとれる報告遅延。制度は性善説に立ち、意図的な隠ぺいは検知できない。OTC、健康食品事業の撤退など人の国に入るものに関わらせるべきではない」、「因果関係の調査は報告後でよかった」、「ずるずると新しい事実が出てくる状況は問題。すべて吐き出してほしい」と、企業体質を指摘する声が強い。過去には、OTCの治験データの改ざん、熱さまし用ジェル状冷却シートによる乳児の窒息事故で、国民生活センターの注意喚起を受けたこともある。
刑事告発の可能性も一部で報道される。ただ、雪印事件は、死亡を含め被害者が1万人以上に上り、大阪府警が業務上過失致死傷の疑いで当時の社長らを書類送検したが、危険性を予見できなかったとして不起訴になっている。厚労省は行政処分について、5月末の定例会見で「食衛法で定める一般衛生管理基準ではカビの発生防止に係る具体的な規定はなく、同法で直ちに問題があったとは言えない。小林製薬への直接の行政処分は、まだ考えていない」と発言している。
一方で食衛法28条は報告遅延の間接罰(罰金50万円)があり、「対象になる可能性はある」(厚労省OB)との見方もある。
「影響ない」もルール強化「仕方ない」
「紅麹」の健康被害問題を受け、政府は、健康被害報告のルール化、サプリメントのGMPを届出事項とすることで実質的に義務化する。食衛法にひもづく施行規則、機能性の届出事項を示す食品表示基準に基づく届出ガイドラインの改正は9月施行に向けパブリックコメントを行っている。
被害報告は、「医師の診断」のあるものについて、「因果関係不明」でも報告を義務化するが、医師の診断は、診断書まで求めず、診察を受けたものも対象になる。厚労省は今年3月、「紅麹」をめぐり、無症状の患者に対する診察も診療報酬(初診料等)の算定を認めており、報告件数は増える可能性がある。
複数社が「個社の製造の問題、かつ原因不明なままで機能性表示食品制度の問題にされている」などとするが、制度厳格化に「一定のハードルは仕方ない」、「安全、安心感の醸成で信頼回復を図る必要がある」と受け入れる。小林製薬には、「対厚労省ではなく、自主的な会見の機会を増やし、信頼回復に努めてほしい」との意見がある。
被害救済など受け皿検討も
サプリメントが法的に位置づけられていない問題もある。米国では、法令違反の対象事業者の公表を行い、医薬品を規制する薬機法も責任役員制度で法令遵守、役員の責任逃れを防ぐ。「法改正を伴わない府省令レベルの対応では、明確な罰則もかけられない」(厚労省OB)など、抜本的な改革を求める声もある。
業界主導の環境整備も必要だ。医薬品は副作用被害救済制度があり、事業者団体による損害保険加入制度の導入は検討に値する。「厳罰化は意味がなく、大多数の真面目な事業者の迷惑。報告隠しの抑制は、医薬品のICHガイドラインのように、品質や安全性、機能性について検討する専門家会議が必要。まず15日など期限を区切り報告させ、因果関係判定や内容精査を称する報告遅延させない環境づくりが必要」との意見もある。信頼回復に向け、”受け皿”整備など、業界の取り組みが必要になる。
会見「予定していない」、健食通販の継続方針「変更ない」
<小林製薬の対応>
小林製薬は、厚労省に二度の報告遅延を指摘された。ただ、会見の予定は「リリースで公表した通り。現時点で予定していない」とする。同社に報告遅延の理由、今後の事業方針を聞いた。
――厚生労働大臣の遺憾表明の受け止めは。
「速やかに報告すべきとの指摘を大変重く受け止めている。関係者に多大な迷惑をおかけしたことに改めて深くお詫び申し上げる。今後、被害発生状況の把握・報告とともに、製品回収、お客様からの問い合わせや補償への誠実な対応、原因究明に全力で取り組む」
――6例目の死亡例の確認はいつか。
「健康被害の報告・公表のあり方の見直しを継続的に検討する中、6月13日に厚生労働省から問い合わせを受け、見直しを加速させ、同27日の報告、28日の公表に至った」
――小林章浩社長への報告頻度は。
「適宜報告していた」
――問題があると公表された原料ロット以外で製造された製品の有無は。
「調査中のため回答できない」
――厚労省と見解の相違の理由は。
「リリースに沿った内容(注・腎疾患の発症から、製品摂取による疑いのある事例数)に変更を予定している」
――因果関係が確認できたものを報告する方針だったのか。報告しなかった理由は。
「76例の死亡の関連性を調査しており、確認が完了していなかった。当初は速報性を重視し、申告内容のみに基づき報告していたが、関連性が遠いと思われる事例もあり、詳細な確認を重視した」
――報告が約2カ月遅れた理由は。
「公表まで時間を要してしまい申し訳ない。当社として、影響を把握するための調査に時間を要した。(問題とされる成分との)因果関係も不明だったが、被害拡大防止を最優先に考え公表した」
――加盟する日本通信販売協会、日本健康・栄養食品協会等の業界団体への報告は。
「個別案件のため回答は控える」
――製造工場の問題に焦点を当てた原因究明、検証は行っているか。製造管理、品質など貴社の問題と捉えているか。
「原因究明は厚労省主導で、当社も引き続き迅速な究明に貢献すべく必要な情報提供を行っている」
――機能性表示食品の問題と捉えているか。
「機能性表示食品のあり方は、政府が対応策をまとめているため、弊社としてその内容を遵守していく」
――通販の定期解約は。
「回答を控える」
――健康食品通販は、3月29日の会見時点で継続を念頭に置いていた。変更はあるか。
「変更はない」
――機能性表示食品の販売は継続するか。
「今後の事業計画に関わるため控える」
――機能性表示食品をはじめ、他社や健康食品業界、通販業界に与える影響への見解は。
「機能性表示食品市場全体の売り上げが下がったとの報道もあり、業界関係者に迷惑をかけ申し訳ないと考えている。影響がどの程度続くかは予測しかねるが、原因究明、再発防止の取り組みを進め信頼回復に努めたい」
――台湾における集団訴訟の対応方針は。
「訴状が届いていないため、現時点でコメントができかねる。台湾の法制度、弊社紅麹原料と健康被害の法的な因果関係等も踏まえ、適切に対応する」。
――国内外の法的措置の把握は。
「回答は控える」